08 Marzec 2026
Sie 202017
Epidemiologia raka jelita grubego
Rak jelita grubego (okrężnicy) jest jednym z najczęściej występujących nowotworów złośliwych w Europie, w Polsce plasuje się według zachorowalności w 2017 roku na 4. miejscu w przypadku mężczyzn i 5. w przypadku kobiet. Niestety zachorowalność na ten nowotwór powoli ale systematycznie wzrasta.
Według Krajowej Bazy Danych Nowotworowych Centrum Onkologii w Polsce, w 2017 roku raka okrężnicy rozpoznano u 10905 osób, w tym 5832 mężczyzn i 5073 kobiet. Pod względem śmiertelności rak jelita grubego zajmuje 3. pozycję wsród wszystkich nowotworów, tak w przypadku kobiet, jak i mężczyzn. W 2017 roku odnotowano 7754 zgonów z tego powodu (mężczyźni – 4181; kobiety – 3573). Nowotwór okrężnicy rzadko występuje u osób poniżej 40. roku życia, najwięcej zachorowań przypada na 7. i 8. dekadę życia.
Etiopatogeneza – przyczyny powstawania raka jelita grubego
Większość raków jelita grubego to nowotwory sporadyczne (około 65–85%), pozostałe zaś to raki występujące rodzinnie. Rak jelita grubego powstaje i rozwija się w wyniku zmian zachodzących w genomie komórki: mutacji w genach odpowiedzialnych za hamowanie niekontrolowanej proliferacji (mutacje genów między innymi hMSH, hMLH1, PMS1 tzw. mismatch repair genes, geny mutatorowe) oraz w genach odpowiedzialnych za naprawę uszkodzonego DNA.
Pod wpływem czynników torujących zmutowane komórki dzielą się szybciej niż prawidłowe, przekazują mutację potomnym, w związku z czym powstaje klon komórek – mutantów mających zdolność szybkich podziałów, kolejnych mutacji i samonapędzania się do wzrostu oraz dalszego podziału. Geny regulatorowe – naprawcze, na skutek mutacji tracą swoją funkcję – dochodzi do spadku kontroli nad cyklem komórkowym.
Polipy jelita grubego są bardzo często podłożem rozwoju raka. Ryzyko transformacji złośliwej związane jest z typem histologicznym polipa. Ze względu na budowę histologiczną wyróżnia się polipy:
- hiperplastyczne (metaplastyczne) — stanowią 90% polipów jelita grubego, osiągają niewielkie rozmiary (5 mm) i są utworzone przez pogrubiałą błonę śluzową bez cech atypii komórkowej; występują u około 75% dorosłych;
- gruczolakowe — są zmianami niezłośliwymi, jednak wykazują istotną zdolność przemiany złośliwej. Wyróżniamy wśród nich:
- gruczolaki cewkowe (adenomata tubularia) — stanowią 75% polipów gruczołowych; 5% z nich to zmiany złośliwe,
- gruczolaki kosmkowe (adenomata villosa) — stanowią 10% gruczolaków; w 40% tych zmian znajduje się ognisko raka,
- gruczolaki cewkowo-kosmkowe (adenoma tubulovillosa) — stanowią 15% gruczolaków; 20% z nich to polipy złośliwe.
Poza budową histologiczną wykazano zależność między wielkością polipa, a występowaniem raka jelita grubego na jego podłożu: im większy polip tym większe ryzyko transformacji złośliwej (np. występowanie polipa gruczolakowego o wielkości < 1 cm wiąże się z 0,5 – 1% prawdopodobieństwem obecności raka inwazyjnego; gdy polip osiąga wielkość > 2 cm, prawdopodobieństwo wynosi już 10–50%).
Leczenie polipów jelita grubego, w tym także polipów złośliwych, polega na ich endoskopowym lub chirurgicznym wycięciu (badanie histopatologiczne preparatu w całości). Po polipektomii zaleca się wykonanie kontrolnej kolonoskopii po upływie 5–10 lat lub po 3 latach, gdy istnieje większe prawdopodobieństwo wznowy, usunięto więcej niż 3 gruczolaki lub wywiad rodzinny obliguje do częstszych kontroli. Usunięcie nieuszypułowanego gruczolaka we fragmentach wymaga kontrolnej kolonoskopii już po upływie 2–6 miesięcy w celu oceny doszczętności polipektomii (ze względu na możliwość wznowy w miejscu).
Uwarunkowane genetycznie nowotwory jelita grubego stanowią mniejszość, bo około 15% ogółu. Rodzinna polipowatość gruczolakowa (FAP) jest rzadko występującą (1 na 10 000 urodzeń) chorobą charakteryzującą się występowaniem w jelicie grubym znacznej liczby polipów gruczolakowych (> 100), dziedziczona jest w sposób autosomalny dominujący (mutacje genu APC). Praktycznie u wszystkich chorych na FAP jeszcze przed 35. rokiem życia rozwija się rak jelita grubego. Jedynym skutecznym sposobem terapii w przypadku tego rozpoznania pozostaje pankolektomia – całkowite wycięcie jelita grubego – profilaktyczna, gdy istnieje ryzyko rozwoju raka, lub lecznicza w razie postawienia diagnozy raka. Ponieważ u 5% osób rak może się rozwinąć przed 20. rokiem życia, zalecane jest kontrolowanie kolonoskopowe u młodych członków rodzin i wykonanie profilaktycznej pankolektomii wkrótce po rozpoznaniu FAP.
Inne czynniki ryzyka zachorowania na raka jelita grubego:
- epidemiologiczne — wiek (szczyt zapadalności przypada na 7-8 dekadę życia), masa ciała – nadwaga i otyłość(wskaźnik BMI > 30), brak aktywności fizycznej – sporadyczna bądź mała aktywność, mężczyźni przedstawiciele rasy białej, czynniki geograficzne (największa zapadalność w krajach północnej Europy);
- genetyczne: występowanie raka jelita grubego wśród krewnych 1. stopnia (przy braku potwierdzonego genetycznie uwarunkowanego zespołu), zwłaszcza, gdy w kolejnych pokoleniach obserwuje się kolejne przypadki raka jelita grubego; potwierdzone w badaniach molekularnych uwarunkowane genetycznie zespoły chorobowe prowadzące do rozwoju raka (FAP, HNPCC), występowanie w wywiadzie polipów gruczolakowych lub raka jelita grubego, nawracające, przewlekłe stany zapalne jelit (idiopatyczne: wrzodziejące zapalenie jelita grubego oraz choroba Leśniowskiego-Crohna);
- związane z błędami dietetycznymi i stylem życia – zwiększona zawartość tłuszczów w diecie (zwłaszcza nasyconych kwasów tłuszczowych), dieta bogata w krwiste mięsa, tłuszcze zwierzęce i pokarmy na nich smażone, potrawy wędzone i wysoko przetworzone, obecność sztucznych dodatków i środków konserwujących, dieta uboga w błonnik i produkty świeże, witaminy i pierwiastki śladowe, niedobór wapnia (efekt protekcyjny), spożywanie alkoholi, głównie wysokoprocentowych.
- mieszane – palenie tytoniu, żucie produktów tytoniowych, obecność ureterosigmoidostomii (500-krotnie większe ryzyko rozwoju raka jelita grubego); przebycie cholecystektomii lub radioterapia w wywiadzie na obszar jamy brzusznej i miednicy.
Profilaktyka raka jelita grubego
Profilaktyka i skryning raka jelita grubego.
Rak jelita grubego pozostaje drugą co do częstości przyczyną zgonów z powodu choroby nowotworowej. Dla przeciętnej osoby, bez dodatkowych czynników ryzyka, ryzyko zachorowania na raka jelita grubego w ciągu całego życia wynosi około 5%. U osób z obciążonym wywiadem rodzinnym ryzyko to jest dwukrotnie większe. Jak w przypadku każdego nowotworu, szansa wyleczenia jest największa we wczesnym stadium choroby, niestety u około 25% chorych rozpoznanie stawia się późno, już w momencie wystąpienia przerzutów.
Mimo znacznych postępów leczenia jedna trzecia chorych na raka jelita grubego umrze z powodu tej choroby. Jednym z najważniejszych czynników ryzyka raka jelita grubego jest wiek. 90% przypadków tej choroby wykrywa się u osób po 50 roku życia, chociaż może ona wystąpić także u osób bardzo młodych. Dlatego w każdym wieku zwracamy uwagę na tak zwane objawy alarmowe, wskazujące na konieczność szybkiej diagnostyki.
Polipy jelita grubego
Pacjenci często nie mają świadomości, że wczesny rak jelita grubego może nie dawać żadnych objawów. Zachęcani do badań profilaktycznych odpowiadają, że przecież czują się świetnie i nie mają problemów z jelitami. Zgłaszają się do lekarza zwykle w momencie wystąpienia krwawienia z odbytu lub znacznej utraty wagi, albo nieprawidłowych wyników badań krwi. Tymczasem około 30% osób po 50 roku życia ma w jelicie grubym zmiany przedrakowe czyli gruczolaki, zwane potocznie polipami.
Ogromna większość przypadków raka jelita grubego powstaje właśnie z takich polipów. Polipy najczęściej nie dają żadnych objawów. Część polipów nigdy nie przekształci się w raka, ale wiadomo, że wykonywanie badań w celu wykrycia i usunięcia polipów bardzo znacznie zmniejsza ryzyko zachorowania na nowotwór złośliwy jelita grubego.
Kolonoskopia – badanie w profilaktyce raka jelita grubego i endoskopowe usuwanie polipów
Wykrywanie i usunięcie polipów jelita grubego umożliwia badanie endoskopowe, czyli kolonoskopia. Polega ono na wprowadzeniu do jelita giętkiego wziernika zwanego endoskopem, zaopatrzonego w źródło światła. W czasie badania ogląda się błonę śluzową całego jelita grubego. Większość polipów można usunąć w czasie badania endoskopowego za pomocą specjalnych narzędzi wprowadzanych przez kanał endoskopu. Usuwanie polipów jest dla pacjenta nieodczuwalne. Zabieg wiąże się z niewielkim ryzykiem krwawienia, które zwykle ustępuje samoistnie bez konieczności dalszych interwencji.
Bardzo rzadko zdarza się, że wykryte w czasie badania polipy są zbyt duże do usunięcia endoskopowego i wymagają zabiegu operacyjnego. Zdarza się czasami, że po zbadaniu pod mikroskopem usuniętego polipa otrzymujemy informację, że było w nim obecne ognisko wczesnego raka. W zależności od sytuacji pacjent może wymagać jeszcze leczenia uzupełniającego, ale w części przypadków już sama kolonoskopia z usunięciem polipa jest wystarczająca do wyleczenia.
Jeżeli kolonoskopia nie wykaże obecności polipów, kolejne badanie profilaktyczne jest zalecane po upływie dziesięciu lat, o ile rzecz jasna nie wystąpią inne powody wykonania badania. W razie stwierdzenia polipów czas badania kontrolnego ustala się na podstawie ich liczby, wielkości oraz obrazu mikroskopowego.
Badanie kału na obecność krwi utajonej (krew utajona w stolcu)
U osób, które z różnych przyczyn nie decydują się na kolonoskopię istnieje możliwość zastosowania innych metod wczesnej diagnostyki. Jedną z tych metod jest badanie stolca w kierunku obecności krwi utajonej. Badanie to powinno się wykonywać co roku. Zazwyczaj nie wykrywa ono polipów, które w większości przypadków nie krwawią, ale może wykryć obecność raka jeszcze przed wystąpieniem dolegliwości. Dzieje się tak dlatego, że w początkowym stadium rak jelita grubego powoduje krwawienia niewykrywalne gołym okiem. Badanie stolca metodami chemicznymi pozwala na stwierdzenie obecności nawet niewielkiej ilości krwi. Dodatni wynik badania wymaga dalszej diagnostyki, tzn. wykonania kolonoskopii.
Kolonoskopia wirtualna (kolonografia TK)
Stosunkowo niedawno pojawiła się możliwość wykonywania tak zwanej kolonoskopii wirtualnej, czyli badania jelita grubego metodą tomografii komputerowej. Badanie wiąże się z ekspozycją na promieniowanie rentgenowskie, ale dla części pacjentów może być alternatywą dla kolonoskopii klasycznej ze względu na mniejszy dyskomfort. Przed badaniem wymagane jest oczyszczenie jelita podobnie jak przed kolonoskopią. W czasie badania konieczne jest podanie do jelita pewnej ilości powietrza, tak zwana insuflacja, oraz podanie do żyły kontrastu. Specjalny program komputerowy umożliwia rekonstrukcję obrazu powierzchni błony śluzowej jelita.
Badanie umożliwia wykrycie zarówno wczesnego raka, jak i polipów. W razie stwierdzenia zmian w obrębie błony śluzowej o wielkości powyżej 5 mm wykonuje się klasyczną kolonoskopię. Jeśli wynik jest prawidłowy, kolejne badanie przesiewowe zalecane jest po 5 latach. Skuteczność kolonoskopii wirtualnej w wykrywaniu polipów powyżej 1 centymetra jest podobna jak kolonoskopii.
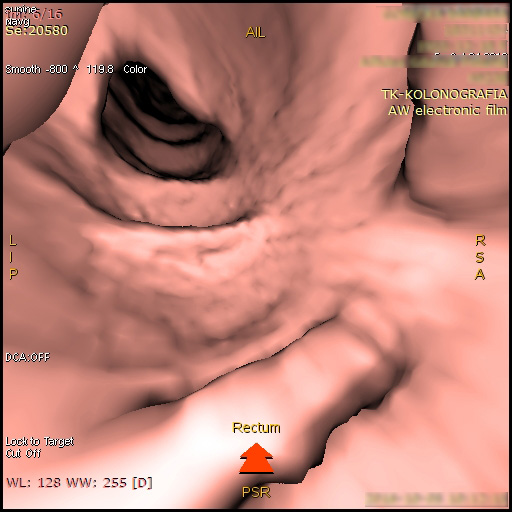
Fot. 1. Obraz jelita grubego w badaniu kolonografii TK
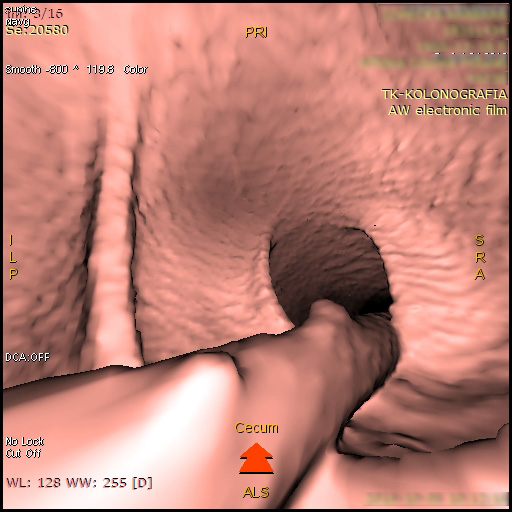
Fot. 2. Obraz jelita grubego w badaniu kolonografii TK
Poprawa wyników diagnostyki i leczenia dzięki badaniom profilaktycznym w raku jelita grubego
Dzięki zastosowaniu opisanych powyżej metod skryningowych udało się w ciągu ostatnich trzydziestu lat wyraźnie zmniejszyć zachorowalność na raka jelita grubego oraz śmiertelność z powodu tej choroby. Wiadomo, że osoba, która przynajmniej raz w życiu miała wykonaną pełną kolonoskopię, ma ryzyko zachorowania na raka jelita grubego dziesięć razy mniejszą niż osoba, która nigdy jej nie miała.
Endoskopia kapsułkowa
W ostatnich latach duże zainteresowanie pacjentów budzi tak zwana endoskopia kapsułkowa jelita grubego. Polega ona na badaniu jelita za pomocą połykanej przez pacjenta mikrokamery, która przemieszcza się w świetle jelita biernie pod wpływem fal perystaltycznych, wykonując zdjęcia z częstością od 2 do 3 klatek na sekundę.
Chociaż jest to badanie mało inwazyjne i dobrze tolerowane, należy podkreślić, że jego czułość jest zbyt niska dla wczesnego wykrywania raka i polipów jelita grubego. Badanie jelita grubego za pomocą kapsułki pozwala wykryć zaledwie 70% polipów większych niż 6 mm, nie zawsze też pozwala wykryć raka. Z tego względu badanie to nie jest obecnie zalecane w rutynowej prewencji raka jelita grubego.
W jaki sposób uchronić się przed rakiem?
W prewencji raka jelita grubego dużą rolę odgrywa prawidłowa dieta (bogata w warzywa i owoce, uboga w czerwone mięso). Wydaje się, że pewną niewielką rolę ochronną może odgrywać także spożycie mleka i nabiału. Wyraźnie mniejsze ryzyko zachorowania obserwuje się również u osób dbających o regularny wysiłek fizyczny. Mechanizm tego zjawiska nie jest znany i prawdopodobnie nie zależy wprost od samej masy ciała.
W celu zmniejszenia ryzyka inwazyjnego (złośliwego) nowotworu jelita zaleca się opisane powyżej badania przesiewowe, wykonywane w regularnych odstępach czasu począwszy od 50 roku życia u osób o przeciętnym ryzyku, lub od 40 roku życia u osób z obciążonym wywiadem rodzinnym (z jednym lub więcej krewnym pierwszego lub drugiego stopnia z rozpoznanym rakiem jelita grubego).
Najważniejsze jest jednak, by nie bać się szukać pomocy lekarskiej w sytuacji, gdy coś nas niepokoi. Wiele osób odwleka wizytę u lekarza z obawy przed rozpoznaniem choroby nowotworowej, tymczasem wczesne wykrycie nawet tak poważnej choroby, jaką jest rak jelita grubego, wiąże się z dużą szansą całkowitego wyleczenia.
Objawy alarmowe wskazujące na konieczność pilnej diagnostyki:
- Obecność krwi w stolcu
- Niezamierzona utrata wagi
- Niedokrwistość (anemia) z niedoborem żelaza
- Narastające bóle brzucha, często w nocy
Badania przesiewowe
Badanie przesiewowe stanowią zasadniczą metodę profilaktyki nowotworowej w przypadku wielu nowotworów (rak piersi, rak szyjki macicy, rak jelita grubego). Celem badań profilaktycznych jest wykrywanie i leczenie gruczolaków oraz wykrycie raka jelita grubego we wczesnych stadiach zaawansowania, gdy dostępne procedury chirurgiczne, jak i onkologiczne leczenie uzupełniające są w pełni skuteczne i dają duże prawdopodobieństwo pełnego wyleczenia.
Standardowy protokół badania przesiewowego:
– badanie kału na krew utajoną, co 12 miesięcy: 2 próbki z 3 kolejnych stolców (wynik pozytywny 1 na 6 jest wskazaniem do kolonoskopii);
– kolonoskopia co 10 lat od 50 roku życia.
Badaniom przesiewowym powinna poddać się każda osoba po osiągnięciu 50 roku życia – bez obciążającego wywiadu rodzinnego.
Gdy w wywiadzie rodzinnym chory zgłasza: jeden przypadek raka jelita grubego u krewnego 1 stopnia ≥ 60 roku życia – obowiązuje nadal standardowy protokół badania przesiewowego, ale począwszy od 40 roku życia.
Gdy w rodzinie zanotowano raka jelita grubego u dwóch lub więcej krewnych 1 stopnia z rozpoznanym ≥ 60 roku życia lub jeden przypadek u krewnego 1. stopnia z rozpoznanym rakiem jelita grubego < 60 roku życia — obowiązuje nadal standardowy protokół badania przesiewowego od 40. roku życia lub 10 lat wcześniej niż postawienie diagnozy raka jelita grubego u najmłodszego krewnego.
U pacjentów z dodatnim wywiadem w kierunku HNPCC – począwszy od 20-25 roku życia zaleca się wykonywanie pełnej kolonoskopii (z jednoczasowym usunięciem polipów) co 1–2 lata, ponadto od 30. roku życia kontrolne gastroskopie co 2 lata, u kobiet dodatkowo coroczne badania przesiewowe pod kątem raka trzonu macicy (biopsja aspiracyjna endometrium, przezpochwowe badanie USG), począwszy od 25–35 roku życia.
U pacjentów z dodatnim wywiadem w kierunku FAP – zaleca się badanie genetyczne i kolonoskopię co 12 miesięcy od 12-15 roku życia.
W przypadku postawionej diagnozy idiopatycznych zapaleń jelit (wrzodziejące zapalenie jelita grubego, choroba Leśniowskiego-Crohna) zaleca się kontrolną kolonoskopię (z losowym pobraniem wycinków) co 1–2 lata. Badanie należy rozpocząć po 8 latach trwania choroby przy pancolitis (zmiany dotyczą całego jelita grubego) lub po 15 latach, jeżeli schorzenie dotyczy jedynie lewej połowy okrężnicy.
Histopatologia raka jelita grubego
W jelicie grubym przeważają guzy o histologicznym typie gruczolakoraka cewkowego. Gdy komponenta guza zawiera komórki sygnetowate (rak sygnetowatokomórkowy) bądź utkanie drobnokomórkowe, rzadko spotykane, można spodziewać się gorszego rokowania.
Anatomicznie rak jelita grubego lokalizuje się: w odbytnicy (30–50%), esicy (15–20%), wstępnicy (14%), poprzecznicy (9%) i zstępnicy (6%); łącznie cała okrężnica przeważa nad odbytnicą.
Ocena patologa preparatu musi umożliwiać określenie cech klasyfikacji TNM, zawierać informacje o inwazji naczyń krwionośnych i limfatycznych, a także pozwalać na ocenę doszczętności resekcji – cecha R (R0 wolny margines mikroskopowy, R1 wolny margines makroskopowo, mikroskopowo obecność komórek w linii cięcia chirurgicznego, R2 dodatnie marginesy makro i mikroskopowe).
Wskazane jest także umieszczenie informacji o stopniu złośliwości histologicznej nowotworu, wielkości marginesu radialnego oraz odsetku żywych komórek nowotworowych w guzie u chorych po przedoperacyjnej chemioterapii (ypTNM).
Objawy raka jelita grubego
We wczesnych stadiach choroby objawy nie występują, są skąpe bądź niespecyficzne: ból brzucha i wzdęcia, które mogą sugerować mniej groźne dolegliwości, kojarzone często z błędem dietetycznym, przyjmowanymi lekami, objawami ze strony dróg żółciowych czy wynikającymi z choroby wrzodowej.
Bywa również i tak, że rak jelita grubego przez długi czas nie daje żadnych objawów, a diagnoza stawiana jest przypadkowo podczas kontrolnej kolonoskopii. Chorzy objawowi zgłaszają różne dolegliwości w zależności od umiejscowienia guza pierwotnego: rakom prawej połowy okrężnicy najczęściej towarzyszy osłabienie ogólne, brak łaknienia, krew w stolcu (często utajona, nie objawowa), anemia bez innych objawów ze strony przewodu pokarmowego (okresowe spadki poziomów hemoglobiny), utrata masy ciała, rzadziej natomiast zmiana rytmu wypróżnień.
Chorzy z nowotworem w lewej części okrężnicy i odbytnicy częściej skarżą się na zaparcia (postępujący naciek komórek nowotworowych powoduje stopniową okluzję światła jelita i upośledzenie jego drożności), naprzemiennie z biegunkami, trudności z wypróżnieniem – stolce twarde, „ołówkowate”, wzdęcia, kurczowe bóle brzucha, postępujące objawy niedrożności. Nowotworom nisko zlokalizowanym (odbytnica) towarzyszy uczucie niepełnego wypróżnienia, naglące i bolesne parcia, świeża krew w stolcu.
Chorzy operowani z powodu raka jelita grubego w około 20% diagnozowani są w stadium rozsiewu. Nowotwór jelita grubego rozprzestrzenia się drogą krwionośną lub limfatyczną, a także przez ciągłość w obrębie jamy otrzewnej, zajmując sąsiednie narządy. Najczęstsze przerzuty raka jelita grubego występują w wątrobie, płucach (droga krwionośna), węzłach chłonnych, w obrębie jamy otrzewnej, a także ostatecznie w kościach i mózgu. Przerzutom towarzyszą objawy charakterystyczne dla zajętego narządu.
Ocena zaawansowania raka jelita grubego
W przypadku raka jelita grubego, pierwszym badaniem jest kolonoskopia – umożliwia ocenę całego jelita grubego, poza tym pozwala na usunięcie polipów i w przypadku istnienia guza, na pobranie materiału do badania histologicznego. Poza tym wykonuje się następujące badania obrazowe: USG, tomografię komputerową jamy brzusznej i miednicy (przerzuty do narządów miąższowych, powiększone węzły zaotrzewnowe i okolicy guza, wielkość guza, naciekanie – resekcyjność), RTG lub TK klatki piersiowej, EUS. Rezonans magnetyczny MR pozwala na ocenę głębokości nacieku nowotworowego w ścianie odbytnicy i określenie wskazań do radioterapii przedoperacyjnej, stąd w tym umiejscowieniu guza powinien być badaniem z wyboru.
W chorobie przerzutowej zakres badań obrazowych ustalany jest indywidualnie w zależności od sposobu leczenia. Badanie PET wykonuje się głównie u chorych z podejrzeniem przerzutów w badaniu TK (niejasny obraz i brak możliwości weryfikacji) oraz z przerzutami resekcyjnymi na podstawie badania TK, przed podjęciem decyzji o ich operacyjnym leczeniu.
U każdego chorego należy oznaczyć przedoperacyjne stężenie markera CEA – nie jest to badanie specyficzne, ale umożliwia monitorowanie chorego po leczeniu i w okresie odległym daje możliwość kontroli choroby (wznowa biochemiczna). Śródoperacyjna ocena obecności komórek nowotworu w płynie z jamy otrzewnej daje obraz inwazyjności procesu i ewentualnych wskazań do zastosowania chemioterapii pooperacyjnej.
Rozsiew nowotworu w jamie otrzewnej – naciek otrzewnej, obecność wszczepów otrzewnowych jest wskazaniem do zastosowania, po całkowitej cytoredukcji chemioterapii dootrzewnowej w hipertermii (HIPEC).
Leczenie raka odbytnicy, podobnie jak innych odcinków jelita grubego, polega na wykonaniu zabiegu operacyjnego, w czasie którego usuwa się odcinek jelita wraz z guzem oraz odpowiednim marginesem wolnym od nowotworu, a także z „szypułą” naczyniową zwana krezką.
W przypadku raka odbytnicy, ze względu na umiejscowienia anatomiczne, okoliczne tkanki (tzw. mezorectum) mogą być zajęte przez rozprzestrzeniający się nowotwór i trudne do wycięcia. W tej sytuacji należy przed zabiegiem zaplanować leczenie wstępne, adjuwantowe, polegające zazwyczaj na radioterapii lub radioterapii w skojarzeniu z chemioterapią. Jest ono zależne od określonego stopnia zaawansowania miejscowego.
W celu odpowiedniego ustalenia stopnia zaawansowania miejscowego należy wykonać odpowiednie badania, do których należą m.in. badanie przez odbyt (per rectum) – obowiązkowe przy wstępnej diagnostyce!, badania obrazowe oceniające narządy jamy brzusznej czy nie ma przerzutów (wątroba): ultrasonografia, tomografia komputerowa, badania krwi (marker nowotworowy CEA).
Badanie rezonansem magnetycznym w raku odbytnicy – dlaczego należy je wykonać?
W celu określenia zaawansowania miejscowego guza, w przypadku raka odbytnicy obowiązkowym badaniem jest badanie rezonansem magnetycznym (MRI). To specjalistyczne, zaawansowane technologicznie badanie służy nie tylko do oceny wielkości guza, ale pozwala także na ocenę naciekania okolicznych tkanek przy odbytnicy (mesorectum), naciekania okolicznych narządów (prostata u mężczyzn, narząd rodny u kobiet). Jedną z najbardziej wartościowych cech tego badania jest możliwość określenia stanu regionalnych węzłów chłonnych (cecha N), niezbędna do prawidłowego oznaczenia stopnia zaawansowania, a co za tym idzie, do zaplanowania najskuteczniejszego leczenia.
Jak wygląda badanie rezonansem magnetycznym i co należy o nim wiedzieć?
Inne badania, takie jak tomografia komputerowa czy ultrasonografia przezodbytnicza (transrektalna) mogą być także wykonywane, ale ze względu na wyższość badania MRI w ocenie naciekania tkanek mesorectum i ocenie węzłów chłonnych nie są polecane jako badania zastępcze. Ultrasonografia transrektalna ma swoje miejsce w różnicowaniu wielkości guza w planowaniu do miejscowego wycięcia, ale także nie zastępuje badania MRI w określaniu stopnia zaawansowania klinicznego nowotworu.
Klasyfikacja TNM raka jelita grubego (okrężnicy ) (8. edycja UICC)
Czym jest klasyfikacja TNM i dlaczego jest tak istotna.
| T (tumor) – guz pierwotny nowotworu | |
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się guza pierwotnego |
| Tis | rak in situ |
| T1 | guz nacieka błonę podśluzową |
| T2 | guz nacieka warstwę mięśniową |
| T3 | guz nacieka przez warstwę mięśniową do warstwy podsurowicówkowej bądź tkanki okołookrężnicze lub okołoodbytnicze |
| T4 | guz bezpośrednio nacieka inne narządy lub struktury i/lub przechodzi przez otrzewną trzewną |
| T4a | guz przechodzi przez otrzewną trzewną |
| T4b | guz bezpośrednio nacieka inne narządy lub struktury |
| N (lymph nodes) – stan regionalnych węzłów chłonnych | |
| Nx | nie można ocenić regionalnych węzłów chłonnych |
| N0 | brak przerzutów do regionalnych węzłów chłonnych |
| N1 | obecność przerzutów w 1 do 3 węzłach chlonnych |
| N1a | obecność przerzutów w 1 węźle chłonnym |
| N1b | obecność przerzutów w 2 lub 3 węzłach chłonnych |
| N1c | brak przerzutów w węzłach chłonnych ale są depozyty komórek nowotworowych w warstwie podsurowiczej albo w niepokrytych otrzewną tkankach okołookrężniczych lub okołoodbytniczych |
| N2 | obecność przerzutów w 4 lub więcej węzłach chłonnych |
| N2a | obecność przerzutów w 4 do 6 węzłach chłonnych |
| N2b | obecność przerzutów w 7 lub więcej węzłach chłonnych |
| M (metastases) – przerzuty odległe | |
| M0 | nie stwierdza się obecności przerzutów odległych |
| M1 | Przerzuty odległe do jednego lub więcej organu lub obecność przerzutów do otrzewnej |
| M1a | Przerzuty do jednego organu bez obecności przerzutów do otrzewnej |
| M1b | Przerzuty do dwóch lub więcej organów bez obecności przerzutów do otrzewnej |
| M1c | Obecne przerzuty do otrzewnej bez lub z obecnością przerzutów do innych organów |
Stopień zaawansowania (ang. staging) raka jelita grubego (8. edycja UICC)
| Stopień zaawansowania raka jelita grubego określony na podstawie klasyfikacji TNM | |
| Stopień 0 | Tis N0 M0 |
| Stopień I | T1-T2 N0 M0 |
| Stopień IIA | T3 N0 M0 |
| Stopień IIB | T4a N0 M0 |
| Stopień IIC | T4b N0 M0 |
| Stopień IIIA | T1-T2 N1/N1c M0 |
| T1 N2a M0 | |
| Stopień IIIB | T3-T4a N1/N1c M0 |
| T2-T3 N2a M0 | |
| T1-T2 N2b M0 | |
| Stopień IIIC | T4a N2a M0 |
| T3-T4a N2b M0 | |
| T4b N1-N2 M0 | |
| Stopień IVA | każdy T każdy N M1a |
| Stopień IVB | każdy T każdy N M1b |
| Stopień IVC | każdy T każdy N M1c |
| Tab. Zaawansowanie kliniczne raka jelita grubego wg klasyfikacji Dukes’a w modyfikacji Astlera i Collera | |||
| Dukes | Opis zaawansowania | Zaawansowanie wg Astler/Coller | Przeżycie 5-letnie (%) |
| A | Zmiana nie przekracza błony śluzowej | A | 90 |
| B | Naciekanie błony mięśniowej bez jej przekraczania. Brak przerzutów do węzłów chłonnych | B1 | 75 |
| Naciekanie błony mięśniowej na całej jej grubości. Brak przerzutów do węzłów chłonnych | B2 | 65 | |
| C | B1 + Obecne przerzuty do węzłów chłonnych | C1 | 35 |
| B2 + Obecne przerzuty do węzłów chłonnych | C2 | 25 | |
| D | Obecne przerzuty odległe | D | < 5 |
Leczenie raka jelia grubego
Zasadniczą rolę w terapii raka okrężnicy odgrywa leczenie chirurgiczne. Uzupełniająca chemioterapia u chorych z dużym ryzykiem nawrotu zwiększa odsetek wyleczeń i wydłuża czas przeżycia. U wyselekcjonowanej grupy chemioterapia w postępowaniu paliatywnym istotnie wydłuża czas życia chorych z obecnością przerzutów odległych. W przypadku raka zlokalizowanego w odbytnicy, zwraca się uwagę na rolę radioterapii przedoperacyjnej (zmniejszenie masy guza, możliwość resekcji R0 po radioterapii neoadjuwantowej) – natomiast w leczeniu chorych na raka okrężnicy ma ona marginalne znaczenie.
Według danych pochodzących z badania EUROCARE-4 odsetek 5-letnich przeżyć chorych na raka okrężnicy, u których ustalono rozpoznanie w latach 1995–1999, wyniósł w Polsce 39% (średnia w Europie — 55%). Według SEER (Surveillance Epidemiology and End Results) odsetki 5 – letnich przeżyć (%) w zależności od stopnia zaawansowania nowotworu kształtują się następująco: I 74,0; IIA 66,5; IIB 58,6; IIC 37,3; IIIA 73,1; IIIB 46,3; IIIC 28,0; IV (obecność przerzutów odległych) 5,7%.
Przygotowanie żywieniowe do leczenia chirurgicznego
Chorzy z nowotworami przewodu pokarmowego wykazują w wielu przypadkach cechy niedożywienia, wynikające zarówno z zaawansowania choroby (niedrożność, biegunka, wymioty) jak i zmian metabolicznych, których przyczyną jest stres związany z poważną chorobą.
Stan odżywienia jest jednym z czynników determinujących wybór metody leczenia. Zły stan odżywienia może skutkować niemożnością przeprowadzenia leczenia operacyjnego czy chemioterapii. Wpływa też bezpośrednio na wyniki wdrożonego leczenia, możliwość wystąpienia powikłań i dalsze rokowania.
Istotne jest, aby każdy pacjent był należycie przygotowany do leczenia, a zwłaszcza do zabiegu chirurgicznego. Chorzy w złym stanie odżywienia powinni otrzymać wsparcie żywieniowe przed zabiegiem (preparaty wysokobiałkowe, wysokokaloryczne). Leczenie żywieniowe powinno być nieodłączną częścią właściwego procesu leczniczego.
Więcej informacji w dziale Leczenie żywieniowe.
Leczenie chirurgiczne
Metodę leczenia chirurgicznego dostosowuje się indywidualnie do stopnia zaawansowania i technicznych możliwości wykonania resekcji. Postępowanie chirurgiczne polega na resekcji odpowiedniego fragmentu jelita wraz z regionalnymi węzłami chłonnymi (en block – w raku okrężnicy bez przerzutów odległych – resekcja odcinkowa z zespoleniem, hemikolektomia, hemikolektomia poszerzona, pankolektomia).
W preparacie patologicznym konieczna jest ocena minimum 12 węzłów chłonnych z okolicznego spływu chłonnego, poza resekcją en block usuwa się także wszystkie węzły chłonne budzące podejrzenie oraz inne widoczne zmiany poza zakresem standardowej resekcji. Przy obecności synchronicznych przerzutów do wątroby lub płuc – dokonuje się oceny ich resekcyjności, wycięcia odcinkowego jelita z jednoczesną lub następową resekcją zmian przerzutowych (wątroba – chirurgicznie, termoablacja).
W przypadku choroby zaawansowanej – przerzutowej, ale przy obecności nieresekcyjnych zmian wtórnych w wątrobie lub płucach rozważa się zastosowanie indukcyjnej chemioterapii i po 2–3 miesiącach ocenę odpowiedzi obiektywnej oraz ponowne rozważenie możliwości wykonania zabiegu radykalnego. Niekiedy, w przypadku guza pierwotnego, jeśli istnieje realne zagrożenie zwężeniem jelita lub znacznym krwawieniem z guza – konieczne jest zastosowanie operacyjnego leczenia guza pierwotnego i wdrożenie chemioterapii po zabiegu celem zmniejszenia zmian przerzutowych.
Znaczne stadia zaawansowania nowotworu, tj. zmiany trwale nieoperacyjne, kwalifikowane są do zabiegów paliatywnych (resekcja jelita, zespolenia omijające, kolostomia odbarczająca, endoskopowe protezowanie zwężenia).
W przypadku operacji wykonywanych w trybie pilnym – z powodu podejrzenia nowotworowej niedrożności i ryzyka perforacji – najczęściej wykonuje się kolostomie odbarczające. Do niedrożności jelita grubego spowodowanej nowotworem najczęściej dochodzi w guzach esicy (gdzie fizjologicznie światło jest najwęższe) lub zagięcia śledzionowego. Sytuacja nagła wymaga wytworzenia sztucznego połączenia między światłem jelita a powłokami jamy brzusznej (stomii).
Wytworzenie stomii w zasadniczy sposób wpływa na jakość życia chorego, zwłaszcza na kondycję psychiczną i możliwości jego adaptacji psychosocjalnej po zabiegu, narzuca konieczność zmiany diety, wdrożenia odpowiednich zasad higieny i codziennego funkcjonowania. Dlatego przed każdym zabiegiem w obrębie jelita chory powinien zostać poinformowany o możliwości wytworzenia stomii. Otwór stomijny powinien być dobrze zaplanowany: przechodzić przez mięsień prosty brzucha, z dala od linii cięcia chirurgicznego (by nie doprowadzić do kontaminacji), blizn i zniekształceń skórnych oraz być umiejscowiony na fałdzie skórnym (ważne u osób otyłych).
W trybie planowym wykonywane są następujące rodzaje resekcji:
- wycięcie prawej połowy okrężnicy z zespoleniem jelita krętego z poprzecznicą – w przypadku guzów kątnicy lub wstępnicy; w rakach zgięcia wątrobowego okrężnicy zaleca się wykonanie tak zwanej poszerzonej hemikolektomii prawej (usunięcie kątnicy, wstępnicy i poprzecznicy), z uwagi na ryzyko rozwoju przerzutów w węzłach chłonnych położonych wzdłuż naczyń okrężniczych środkowych
- wycięcie poprzecznicy – w przypadku guzów środkowej części poprzecznic – jeśli guz jest położony w pobliżu zagięcia wątrobowego – wykonanie poszerzonej prawej hemikolektomii, natomiast u chorych, u których guz dotyczy zgięcia śledzionowego poszerzonej lewej hemikolektomii;
- wycięcie lewej połowy okrężnicy – w przypadku nowotworów zstępnicy, a także niektórych nowotworów esicy;
- sigmoidektomia – wycięcie esicy – w przypadku guzów położonych w esicy
- prawie całkowite wycięcie okrężnicy – w przypadku synchronicznych nowotworów jelita grubego, raków metachronicznych po wcześniejszym częściowym usunięciu okrężnicy, mechanicznej niedrożności okrężnicy z perforacją jelita (np. kątnicy) lub bez, profilaktycznie – w przypadku FAP bądź w przypadku raka jelita grubego u nosiciela FAP oraz u niektórych chorych na HNPCC;
- poszerzony zabieg operacyjny – w przypadku raka zaawansowanego miejscowo naciekającego sąsiednie narządy (jelito cienkie, macicę, jajniki, pęcherz moczowy, żołądek, śledzionę, trzustkę, nadnercza, nerki, moczowód) – z jednoczasowym zabiegiem naprawczym, bądź cytoredukcja z peritonektomią (usunięciem zajętej przez proces nowotworowy otrzewnej) z podaniem chemioterapii dootrzewnowej w hipertermii do jamy otrzewnej. Celowość wykonywania takich zabiegów uzasadniają dość dobre wyniki przeżyć odległych.
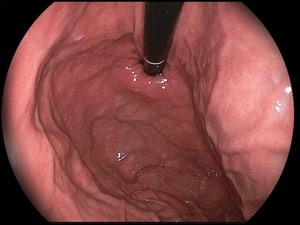
Fot. Rak jelita grubego. Guz umiejscowiony w kątnicy.
Leczenie uzupełniające raka okrężnicy
Podstawowym wskazaniem do stosowania leczenia uzupełniającego jest III stopień zaawansowania nowotworu (guz T1-T4 z obecnością przerzutów do węzłów chłonnych). U chorych z tej grupy zawsze stosuje się uzupełniającą chemioterapię, o ile nie występują przeciwwskazania do podawania cytostatyków (choroby współistniejące). W II stopniu zaawansowania zastosowanie leczenia uzupełniającego jest przedmiotem kontrowersji – obecność cechy T4, a zwłaszcza T4b (stopień IIC), może stanowić do niego samodzielne wskazanie.
Poza tym, leczenie uzupełniające można rozważać przy współistnieniu czynników większego ryzyka wznowy, takich jak: cecha T4a, duży stopień złośliwości histologicznej, mała liczba usuniętych węzłów chłonnych, perforacja guza w trakcie procedury chirurgicznej, zabieg wykonywany w trybie doraźnym (niedrożność, perforacja), inwazja naczyń dookoła guza.
Leczenie systemowe – chemioterapia w przypadku przerzutowego raka jelita grubego
W leczeniu paliatywnym przerzutowego raka jelita grubego (stopień IV) stosuje się z powodzeniem schematy zawierające Fluorouracyl – w porównaniu z leczeniem wyłącznie objawowym zmniejsza względne ryzyko zgonu o 35% oraz zwiększa odsetek przeżyć 1-rocznych o 16% i medianę czasu przeżycia o 3,7 miesiąca.
Obecnie u chorych w dobrym stanie sprawności ogólnej, bez przeciwwskazań w związku z obciążeniami towarzyszącymi preferowane jest zastosowanie w pierwszej linii terapii schematów zawierających poza fluoropirymidyną także irynotekan (np. FOLFIRI) lub oksaliplatynę (np. FOLFOX-4 lub CAPOX). Wybór konkretnego schematu podejmowany jest indywidualnie, zależy od obecności przeciwwskazań do podania irynotekanu lub oksaliplatyny wynikających z chorób towarzyszących i oczekiwanych syndromów toksyczności oraz zaplanowanej strategii leczenia sekwencyjnego. Wydaje się, że chemioterapia nie musi być kontynuowana aż do momentu progresji lub nieakceptowanej toksyczności — racjonalnym postępowaniem w przypadku braku dynamiki zmian nowotworowych może być przerwanie leczenia i jego ponowienie w momencie progresji.
U pacjentów poddawanych metastazektomii z powodu przerzutów do wątroby preferuje się zastosowanie schematów zawierających oksaliplatynę (np. FOLFOX-4, ewentualnie bardziej toksyczny FOLFOXIRI), a ponownej oceny operacyjności należy dokonać najpóźniej po 12 tygodniach od rozpoczęcia leczenia. Nie ustalono, czy dodanie do klasycznych schematów leków ukierunkowanych molekularnie, takich jak przeciwciała anty-EGFR, może zwiększyć skuteczność wstępnej terapii. Czas trwania leczenia systemowego zarówno w przypadku pierwotnej metastazektomii z następową chemioterapią, jak i chemioterapii poprzedzającej metastazektomię nie powinien przekraczać sześciu miesięcy.
Dootrzewnowa chemioterapia perfuzyjna w hipertermii
W przypadku obecności przerzutów do otrzewnej raka jelita grubego zaleca się wykonanie dootrzewnowej chemioterapii perfuzyjnej w hypertermii (DCPH). Warunkiem skuteczności tego zabiegu jest wykonanie zabiegu wycięcia radykalnego guza pierwotnego w zakresie takim, jak w sytuacji gdy nie stwierdza się przerzutów do otrzewnej, oraz wykonania cytoredukcji przerzutów do otrzewnej w jak największym zakresie. Im jest on większy, tym lepsze wyniki zabiegu DCPH.
Dootrzewnowa chemioterapia perfuzyjna w hipertermii – sposób leczenia zmian przerzutowych w otrzewnej raka jelita grubego, raka żołądka, międzybłoniaka otrzewnej, śluzaka rzekomego otrzewnej. Polega na podaniu cytostatyku do płynu perfuzyjnego, ogrzanego do temperatury 42°C, co pozwala na synergistyczne działanie wysokich dawek tych leków i podwyższonej temperatury.
Terapie celowane w raku jelita grubego
EGFR
Receptor naskórkowego czynnika wzrostu (EGFR) jest przezbłonową glikoproteiną o aktywności kinazy tyrozynowej. Zwiększoną ekspresję EGFR stwierdza się w 25 – 80% przypadków raka jelita grubego. Aktywność tego receptora prowadzi do nowotworzenia się naczyń krwionośnych (angiogeneza), zwiększa zdolność komórek do dzielenia się (proliferacja), a także chroni komórki nowotworowe przed naturalnymi procesami śmierci komórki (apoptoza – zaprogramowana śmierć komórki: proces niezwykle ważny dla prawidłowego funkcjonowania organizmu).
Terapie celowane w oparciu o badania molekularne tego receptora polegają na zastosowaniu leków blokujących aktywność receptora EGFR (anty-EGFR). Do takich leków należą m.in. cetuksymab, panitumumab.
KRAS (k-ras)
Białko K-RAS jest protoonkogenem. Białko ma za zadanie przekazywanie sygnału do wzrostu, głównie z układu receptora naskórkowego czynnika wzrostu (EGFR), a co za tym idzie, do przekazywania aktywności związanych z receptorem EGFR.
Mutacje w genie KRAS w rakach jelita grubego są głównym czynnikiem predykcyjnym oporności na terapię celowaną anty-EGFR. Obecność mutacji w nowotworze związana jest z opornością na leki. Mutacje genu KRAS występuje u 30% – 50% chorych z rakiem jelita grubego.
Terapia celowana oparta jest na działaniu leków blokujących receptor EGFR i szlak sygnałowy k-ras. Leki te są skuteczne gdy białko k-ras jest w postaci niezmutowanej (tzw. „typ dziki” – ang. „wild type”). W przypadku mutacji genu białka k-ras leki celowane skierowane przeciwko receptorowi EGFR nie są skuteczne.
Protoonkogen – gen obecny w prawidłowej komórce, w określonych warunkach mający potencjalną zdolność do wyzwolenia przemian nowotworowych
Czynniki predykcyjne – czynniki wskazujące na potencjalną odpowiedź na planowane leczenie
BRAF
BRAF jest kinazą seroninową-treoninową aktywującą kinazy MAP/ERK. Jest częścią składową szlaku sygnałowego MAPK, który kontroluje rozwój komórek nowotworowych. Gen wpływa na proliferację komórek, dojrzewanie i apoptozę. Mutacja genu BRAF jest stwierdzana u około 10% chorych z rakiem jelita grubego. Zaburzenie tego szlaku, w wyniku mutacji BRAF, prowadzi do niekontrolowanego proliferacji komórek i rozwoju nowotworu.
Leki celowane działają w oparciu o zablokowanie białka BRAF, jako jednej z części składowej szlaku MAPK. Do leków tych należą m.in. dabrafenib, wemurafenib (stosowane głównie w leczeniu czerniaka).
MAPK – ang. Mitogen-activated protein kinases – kinazy aktywowane mitogenami
Geny mutatorowe (MMR) i niestabilność mikrosatelitarna (MSI)
Geny mutatorowe kodują białka odpowiedzialne za korekcję błędów powstających podczas replikacji materiału genetycznego (Geny mutatorowe = Geny naprawcze DNA). Korekcja ta polega na usuwaniu źle sparowanych nukleotydów. Jeśli białko naprawcze kodowane przez gen mutatorowy nie usunie błędnie wstawionego nukleotydu mutacja może się utrwalić, zaś matryca do replikacji materiału genetycznego ulega wydłużeniu, co można zmierzyć w obszarach zwanych regionami mikrosatelitów. Jest to t.zw. niestabilność mikrosatelitarna. Niestabilność mikrosatelitarna w raku jelita grubego występuje w około 10% – 20% przypadków.
VEGF
Czynnik wzrostu śródbłonka naczyniowego (VEGF – ang. vascular endothelial growth factor ) jest białkiem sygnalizacyjnym odpowiadającym za angiogenezę (nowotworzenie naczyń krwionośnych – proces niezbędny do rozwoju tkanki nowotworowej). Nadekspresja (zwiększona aktywność) czynnika VEGF jest obserwowana w 50% – 60% przypadków raka jelita grubego.
Terapia celowana w przypadku stwierdzenia nadekspresji czynnika VEGF polega na podawaniu leków blokujących (anty-VEGF), takich jak np. bevacizumab
Obserwacja po leczeniu i postępowanie w przypadku nawrotów
Chorzy na raka okrężnicy po radykalnym leczeniu — według zaleceń ESMO powinni być kontrolowani:
- badanie podmiotowe i przedmiotowe, oznaczanie poziomu CEA co 3–6 miesięcy przez 3 lata i co 6 miesięcy w 4. i 5. roku po leczeniu;
- TK brzucha i klatki piersiowej co 6–12 miesięcy przez 3 lata u chorych z dużym ryzykiem nawrotu;
- kolonoskopia w ciągu 1. roku po leczeniu, później co 3–6 lat w zależności od indywidualnych wskazań;
- badanie PET-CT nie jest rutynowo zalecane
W przypadku stwierdzenia nawrotów choroby – izolowanych, miejscowych, zawsze należy rozważyć możliwość terapii miejscowej – zabieg operacyjny, techniki ablacyjne, w przypadku wznowy w otrzewnej – zabiegi cytoredukcyjne z dootrzewnowo podawaną chemioterapią. W pozostałych przypadkach stosuje się systemowe leczenie paliatywne i objawowe.
Opracowanie:
dr hab. n. med. Tomasz Jastrzębski, prof. ndzw. GUMed
Klinika Chirurgii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Gdańsku,
lek. med. Paulina Cichon
Klinika Chirurgii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Gdańsku.
Źródło onkonet.pl
